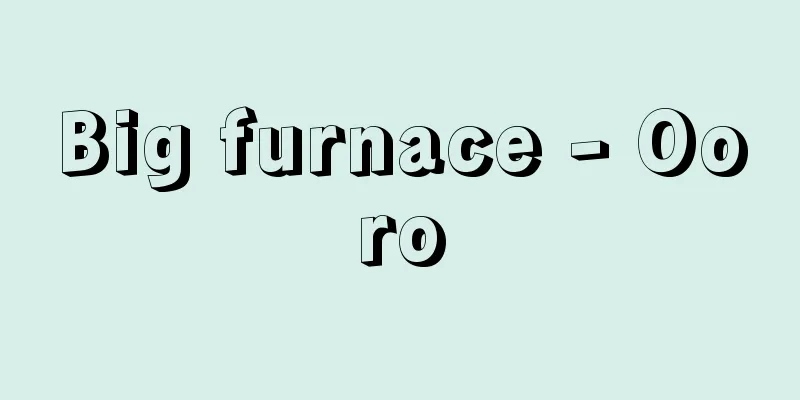Lithium battery - Lithium cell

|
A general term for batteries that use lithium (Li) as the negative electrode active material, and includes primary batteries and secondary batteries (storage batteries). It can also refer to manganese dioxide lithium primary batteries. Lithium is not only a metal with a low electrochemical potential (high ionization tendency), but it is also the lightest of all metals, which gives it a high operating voltage and allows the creation of batteries with high energy density. However, lithium reacts violently with water, so aqueous electrolytes cannot be used. For this reason, primary batteries use organic electrolytes in which lithium electrolyte salts are dissolved in organic solvents, while secondary batteries use organic electrolytes as well as solid electrolytes such as gel polymer electrolytes, solid polymer electrolytes, and glass-based electrolytes, as well as molten salt electrolytes. [Mitsuru Asano] Lithium primary batterySince lithium metal is used for all negative electrode active materials, they are named after the material used for the positive electrode active material. There are manganese dioxide lithium primary batteries, graphite fluoride lithium primary batteries, lithium thionyl chloride primary batteries, copper oxide lithium primary batteries, iron disulfide lithium primary batteries, and iodine lithium primary batteries. Some of these have a nominal voltage of 3.0 volts or more, and have several times the energy density, a long storage life, long durability, low temperature characteristics, and excellent leakage resistance compared to primary batteries such as manganese dry batteries and alkaline manganese batteries. In Japan, cylindrical graphite fluoride lithium primary batteries were developed and sold by Matsushita Electric Industrial Co., Ltd. (now Panasonic) in 1973, followed by coin-type manganese dioxide lithium primary batteries by Sanyo Electric Co., Ltd. in 1975. These primary batteries are used in a wide range of fields, taking advantage of their respective characteristics. In 2002, the production value ratio of lithium primary batteries to all primary batteries was 33%, second only to alkaline manganese batteries. Lithium primary batteries use chemically active lithium metal for the negative electrode and flammable materials such as organic electrolyte, so they must be handled with greater care than conventional batteries that use 1.5 volt aqueous electrolytes. [Mitsuru Asano] Manganese dioxide lithium primary battery Generally, sheet-form lithium metal is used for the negative electrode, and the electrode reaction is Li―→Li + +e - In addition to the coin type, which was the first to be put into practical use, there are also cylindrical types and cylindrical types in packs of two, with the cylindrical types incorporating safety measures to prevent internal pressure buildup in the event of misuse and measures to prevent overcurrent. Taking advantage of their characteristics of high voltage and high energy density, they are used as power sources for watches, cameras, calculators, game consoles, communication devices, memory backup, and more. In electronic watches, they can be used continuously for 5 to 10 years. Initially, it was thought that it would be difficult to use MnO2 as a positive electrode active material, but by heat treating it at around 400 °C to make it nearly anhydrous, it became possible to use it in lithium primary batteries. This has great engineering significance. Since it can be produced cheaply, it has become the mainstream of lithium primary batteries, accounting for more than 90% of production. It is called manganese dioxide lithium battery, manganese lithium battery, or simply lithium battery. [Mitsuru Asano] Graphite fluoride lithium primary battery Graphite fluoride (CF) n is used as the positive electrode active material, and the electrode reaction is generally (CF) n + nLi + + ne - → nLiF + nC [Mitsuru Asano] Lithium thionyl chloride primary battery It was developed mainly in the United States in the early 1970s. The positive electrode active material, thionyl chloride (SOCl 2) , is a liquid and also serves as a solvent for lithium aluminum tetrachloride (LiAlCl 4) , which is used as the electrolyte salt. Therefore, it comes into contact with the negative electrode active material Li in the battery, and the lithium chloride (LiCl) film formed on the Li negative electrode surface by the reaction between the two functions as a solid electrolyte. The positive electrode reaction is 2SOCl 2 + 4Li + + 4e - - → 4LiCl + S + SO 2 [Mitsuru Asano] Lithium copper oxide primary battery The electrode reaction of the copper oxide (CuO) positive electrode is CuO+2Li + +2e - ―→Cu+Li 2 O [Mitsuru Asano] Lithium iron disulfide primary battery The electrode reaction of the positive electrode, iron disulfide (FeS2 ) , is FeS2 + 4Li + + 4e- - → Fe + 2Li2S [Mitsuru Asano] Lithium iodine primary battery The positive electrode active material, iodine I2 , is used in the form of a charge transfer complex P2VP・nI2 with the polymer poly(2-vinylpyridine), and the electrolyte is a 3.0 volt all-solid-state type that uses the reaction product, solid lithium iodide LiI, and has been put to practical use as a power source for artificial heart pacemakers. The positive electrode reaction is P2VP・nI2 + 2Li + + 2e - [Mitsuru Asano] Lithium secondary batteryLithium metal is used for the anode of primary batteries, but as the anode of secondary batteries has many problems with the reversibility of charge and discharge, lithium-absorbed carbon materials, lithium alloys, and composite oxides of lithium and transition metals are used in practical secondary batteries to ensure that the reaction proceeds reversibly. On the other hand, transition metal oxides containing lithium, metal sulfides, conductive polymers, sulfur, organic sulfur compounds, and phosphates are used for the positive electrodes that are combined with these anodes. Lithium secondary batteries are used in a wide range of fields as high-energy density secondary batteries with high discharge voltages, and research and development of new electrode materials, electrolyte salts, organic solvents, etc. is being actively conducted in order to achieve better performance. In 2002, lithium secondary batteries accounted for 48% of all storage batteries, and this is expected to increase in the future. [Mitsuru Asano] Lithium-ion secondary battery It was put into practical use by Sony in 1991. It uses graphite C y Li x , which can insert and remove lithium, as the negative electrode, lithium cobalt oxide Li 1-x CoO 2 as the positive electrode, and an organic electrolyte solution with lithium electrolyte salt dissolved in it. The discharge reaction is (negative electrode) Many types of carbon are used for the negative electrode material, from those with high crystallinity such as natural graphite to those with low crystallinity such as non-graphitizable carbon (hard carbon). Since the positive electrode Li 1-x CoO 2 contains expensive Co, lithium nickel oxide Li 1-x NiO 2 , which is more abundant and cheaper, has also been studied extensively, but as of 2001, only Li 1-x CoO 2 and lithium manganese oxide Li x Mn 2 O 4 are in practical use. Positive electrode materials under consideration include lithium iron phosphate LiFePO 4 , substituted lithium vanadate LiMVO x (M = Cu, Zn, Cd...), and substituted lithium borate LiMBO 3 (M = Mn, Fe, Co...). The organic electrolyte is made by dissolving lithium hexafluorophosphate (LiPF6) or lithium bis(trifluoromethanesulfonyl)imide (LiN( CF3SO2 ) 2 ) as electrolyte salt in a mixed solvent of ethylene carbonate (EC) or propylene carbonate (PC ) and dimethyl carbonate (DMC), methyl ethyl carbonate (MEC), or diethyl carbonate (DEC). Polyolefin porous membranes such as polyethylene are used as separators to separate the positive and negative electrodes and to hold the organic electrolyte. The ionic conductivity of the organic electrolyte is about 102 times lower than that of the alkaline aqueous electrolyte used in nickel-metal hydride batteries, so the electrode plates and separators are made thin and long to improve the discharge characteristics. The operating temperature range is wide, from -20 to 60°C, and the self-discharge rate is small. They are available in cylindrical and rectangular shapes, and the nominal voltage is high, 3.6 volts for the Li 1-x CoO 2 positive electrode and 3.7 volts for the Li x Mn 2 O 4 positive electrode. The energy density is 130-150 Wh/kg and 320-390 Wh/l, which is about three times that of nickel-cadmium batteries and about 1.5 times that of nickel-metal hydride batteries. Japanese manufacturers supply most of the world's demand for lithium-ion secondary batteries, which have led to dramatic developments in mobile electronic devices such as mobile phones, notebook computers, camera-integrated VTRs, and minidisc players. In 2000, Nissan Motor Co., Ltd. released a limited edition hybrid car called "Tino" equipped with a lithium-ion secondary battery that used Li x Mn 2 O 4 as the positive electrode. [Mitsuru Asano] Lithium-ion secondary battery using metal oxide anodeLithium titanate Li4 / 3Ti5/3O4, a defect spinel structure in which Li is inserted into anatase titanium dioxide a- TiO2, has been developed as a transition metal oxide anode material with a stable crystal structure against charge-discharge reactions involving insertion and removal of Li+ ions. Coin-type lithium-ion secondary batteries using lithium manganate LixMn2O4 as the cathode and organic electrolyte have been manufactured and sold since 1994. The operating voltage is 1.5 to 1.2 volts , and the energy density is 40Wh/l, which is smaller than those using carbon materials as the anode, but it can be charged and discharged at 100% of the battery capacity more than 2000 times, and it is resistant to overdischarge and the charging voltage can be freely set between 1.6 and 2.6 volts. For this reason, it is used as a long-term backup power source for solar watches and cordless solar displays, which require safety and reliability rather than high energy density. Other practical applications include a coin-shaped battery using a monoclinic niobium pentoxide Nb 2 O 5 anode and a layered vanadium pentoxide V 2 O 5 cathode, which has been on the market since 1991. It has a discharge voltage of 1.8-1.0 volts and an energy density of 47 Wh/l, and good charge-discharge cycle characteristics. Another battery is known that uses a Nb 2 O 5 anode and a LiCoO 2 cathode, and has a discharge voltage of 2.8-1.5 volts and a high energy density of 107 Wh/l. An amorphous oxide anode is the tin composite oxide SnB 0.5 P 0.5 O 3. In 1996, a cylindrical battery combining LiCoO 2 as a cathode was prototyped, with a discharge voltage of 3.5 volts, an energy density of 135 Wh/kg, and 380 Wh/l. In addition, amorphous lithium silicon composite oxide Li 4 SiO was used for the anode and Li x Mn 2 O 4 (battery voltage 3.0 volts) and Li 4/3 Ti 5/3 O 4 (battery voltage 1.5 volts) were used for the cathode in 1998. In addition, nitride-based Li 3-x M x N (M = Co, Ni, Cu) anodes are being researched. [Mitsuru Asano] Lithium-ion secondary battery using substituted lithium manganate positive electrodeWhen a part of the Mn in LiMn 2 O 4 used as a positive electrode material is replaced with other transition metals to form substituted spinel-type lithium manganese oxide LiMn 2-x M x O 4 (M = Ti, Cr, Fe, Co, Ni, Cu, Zn), the spinel structure is stabilized, and cycle and storage characteristics can be improved. In addition, LiCoMnO 4 , which is replaced with Co, shows a flat discharge voltage not only around 4 volts but also around 5 volts against a Li negative electrode, and LiNi 0.5 Mn 1.5 O 4 also shows 4.7 volts, which has attracted great interest. Although it has inferior capacity and charge/discharge cycle characteristics compared to LiCoO 2 positive electrodes, if an organic electrolyte that can withstand high voltages can be developed, it will be possible to increase the energy density by increasing the voltage of lithium-ion secondary batteries, so further research and development is expected. [Mitsuru Asano] Lithium-ion secondary battery using gel polymer electrolyteIn order to make lithium-ion secondary batteries smaller, lighter, and thinner as portable electronic devices become smaller, a gel-type polymer electrolyte was put into practical use in 1999. Conventional lithium-ion secondary batteries use organic electrolytes, which can leak. To prevent this, gel polymer electrolytes were used instead of liquid electrolytes to seal the batteries, and aluminum laminated films were used instead of iron or aluminum cans to reduce the weight of the containers. This gel polymer electrolyte is made by adding organic solvents as plasticizers to gel polymers and lithium electrolyte salts, and its Li + ion conductivity at room temperature is about 10 -3 S/cm, close to the 5×10 -3 S/cm of organic electrolytes. The active materials for both the positive and negative electrodes are often the same as those used in conventional lithium-ion secondary batteries. The polymers used for gel polymer electrolytes include one-dimensional linear polymers such as polyethylene oxide (PEO), polyvinylidene fluoride (PVdF), polyacrylonitrile (PAN), and PVdF-polyhexafluoropropylene (PHFP) copolymers, the lithium electrolyte salts used are LiPF6 , LiN ( CF4SO2 ) 2 , and lithium trifluoromethanesulfonate ( LiCF3SO3 ) , and the organic solvents used are mainly mixtures of EC and DMC or EMC. In order to improve the heat resistance and mechanical strength of one-dimensional linear polymers, three-dimensional chemically cross-linked gel polymer electrolytes have been researched, in which acrylic monomers are mixed with lithium salts and organic solvents and then polymerized. In order to improve the mobility and conductivity of Li + ions in the positive and negative electrodes, electrodes are used that are prepared by kneading the active materials of both electrodes with gel polymer electrolyte in advance. In addition, various ideas have been devised to improve the adhesion between the positive and negative electrodes and the thin film of gel polymer electrolyte. Lithium-ion secondary batteries using gel polymer electrolytes have the same battery characteristics as those using normal organic electrolytes, and for example, a battery with a graphite | gel polymer electrolyte | LiCoO2 composition can achieve a discharge voltage of 3.6 to 3.7 volts. Thin and flexible types can be manufactured, which contributes to the lightweight and compact design of notebook computers and mobile phones. [Mitsuru Asano] Lithium secondary battery using solid polymer electrolyteThere is a true solid polymer electrolyte made by adding LiN(CF 3 SO 2 ) 2 as an electrolyte salt to a polyethylene oxide copolymer without using organic solvents. The Li + ion conductivity at room temperature is more than two orders of magnitude lower than that of gel polymer electrolytes, but sufficient conductivity can be obtained at 60°C or higher, so it is called a high-temperature lithium secondary battery. Lithium metal can be used for the negative electrode, vanadium oxide VO x is used for the positive electrode, three layers of Li | solid polymer electrolyte | VO x are integrated, and a laminate film is used for the exterior. An all-solid-state lithium secondary battery can obtain a discharge voltage of 2.5 to 2.3 volts at 60°C, has an output density of 400Wh/kg or more, and an energy density of over 300Wh/kg. Since no organic solvent is used as a plasticizer, it has high storage properties, safety, and reliability, and will be put to practical use in fields where room temperature operation is not required. The key to this secondary battery is the development of a solid polymer electrolyte. If a highly ion-conductive polymer electrolyte that can operate at room temperature is developed, we will be one step closer to realizing an all-solid-state lithium secondary battery. [Mitsuru Asano] Lithium secondary battery using polymer cathodeAs of 2000, inorganic substances such as carbon, alloys, and metal oxides are used as electrode active materials in practical lithium secondary batteries, but conductive polymers with conjugated double bonds can also be used. For example, if LiClO4 is used as the electrolyte salt, ClO4- anions are doped (added) to the polymer positive electrode during charging, and Li + cations are doped to the negative electrode at the same time. If the polymer positive electrode active material is represented as (P) n , the charging reaction equation for the positive electrode is as follows: ( P ) n + nxClO4- Initially, polyacetylene was researched as a conductive polymer for the positive electrode, but since it was prone to degradation, polypyrrole, polythiophene, polyacene, etc. were subsequently considered. Then, in 1991, Kanebo and Seiko Instruments marketed a LiPAS negative electrode/LiPAS positive electrode configuration using polyacene-based organic semiconductor (PAS). Polyacene is a carbon material that is carbonized by baking phenolic resin at low temperatures below 700°C. The nominal voltage is 2.5 volts, but the voltage change during discharge is relatively large. Coin-shaped batteries are used for memory backup. Because they are polymers, they can be made thin, making them effective for use in fields that do not require much power. In 1987, Bridgestone and Seiko Instruments put lithium aluminum alloy/polyaniline-based coin-shaped batteries into practical use, but they are no longer in production. [Mitsuru Asano] Lithium secondary battery using organic sulfur compound positive electrodeOrganic disulfide compounds (SRS) have two or more thiolate groups (-SM, M = H, Li, etc.) in the molecule. When charged (oxidized), they polymerize to -(SRS) n -, and when discharged (reduced), they return to the SRS monomer. Therefore, when this property is used as a positive electrode and combined with a Li negative electrode to make a lithium secondary battery, a discharge voltage of 3.0 to 2.5 volts can be obtained at 95°C. Furthermore, when the SRS positive electrode is composited with polyaniline to accelerate the oxidation-reduction reaction rate and make it usable at room temperature, the operating voltage can be increased to 3.4 to 3.2 volts. Furthermore, when a polycarbon disulfide compound (CS x ) n (x = 1.2 to 2.3), in which R in -(SRS) n - is a carbon atom, is composited with a conductive polymer to make a positive electrode, a discharge voltage of 2.4 to 1.7 volts can be obtained, and even when a sulfur element/conductive agent composite system is used as the positive electrode, a discharge voltage of 2.0 volts can be obtained. These configurations make it possible to make a lithium secondary battery. [Mitsuru Asano] Lithium secondary battery using lithium aluminum alloy negative electrodeThe first lithium secondary battery to be put into practical use was a coin-shaped battery with a lithium aluminum (LiAl) alloy anode, which was put into practical use in 1988, earlier than the lithium-ion secondary battery. A typical example is a lithium secondary battery that uses a LiAl alloy anode and modified manganese dioxide (CDMO), developed by Sanyo Electric, for the cathode. MnO2 has various crystal structures, and γ- MnO2 is used for the positive electrode of lithium primary batteries. However, as it deteriorates when used as the positive electrode of secondary batteries through repeated charging and discharging, CDMO, a composite of γ- MnO2 and Li2MnO3 , is used. The LiAl alloy negative electrode has a Li atomic ratio of about 50%, and Mn and other elements are added as third components to suppress pulverization during charging and discharging, improving cycle characteristics. If CDMO is conveniently represented as Mn(IV) O2 , the discharge reaction is (negative electrode) Meanwhile, research into high-temperature lithium secondary batteries using LiAl alloy anodes began at the Argonne National Laboratory in the United States in the 1970s. Initially, Li metal was used, but due to its low melting point, LiAl alloy was used, iron disulfide FeS 2 was used for the cathode, and lithium chloride LiCl-lithium bromide LiBr-potassium bromide KBr molten salt (eutectic temperature 320°C) was used for the electrolyte, with an operating temperature of 400-450°C. The discharge reaction is (negative electrode): In addition to LiAl alloys, lithium alloys with magnesium, silver, lead, bismuth, cadmium, and germanium, as well as lithium Wood's alloy, are known to be usable for the anode. In addition, Mg 2 Sn and Sn-Ca alloys are being considered for use in the anode. [Mitsuru Asano] Thin-film solid-state lithium secondary batteryIn 1993, a thin- film solid-state lithium secondary battery with a thickness of several micrometers was developed in collaboration with Oak Ridge National Laboratory and the University of Kentucky in the United States. The battery uses a thin film of lithium phosphorus oxynitride (Li x PO 4-y N y ) as a solid electrolyte, which is made by sputtering lithium orthophosphate (Li 3 PO 4 ) in nitrogen gas (by irradiating it with ions and attaching the material that is released). This battery is made by sequentially depositing thin films of Li anode, Li x PO 4-y N y electrolyte, and V 2 O 5 cathode, and has a discharge current density of 100 μA/cm 2 in the range of 3.7 to 1.5 volts. In addition, thin-film solid-state lithium secondary batteries that combine a lithium iodide-phosphorus pentoxide-phosphorus pentasulfide glassy solid electrolyte with a titanium disulfide TiS 2 cathode and Li anode are being researched. [Mitsuru Asano] "Battery User's Guide" by Takamura Tsutomu and Sato Yuichi (1988, Corona Publishing)" ▽ "Battery Evolution and Electronics - Thin, Small, High Performance" by Ikeda Hironosuke (1992, Kogyo Chosakai)" ▽ "Illustrated Guide to Batteries" by Ikeda Hironosuke, Takeshima Genji and Umeo Yoshiyuki (1996, Nihon Jitsugyo Publishing)" ▽ "The Latest Technology of New Secondary Battery Materials" edited by Ogumi Zenpachi (1997, CMC)" ▽ "The Story of Lithium-Ion Secondary Batteries - Popular Science" by Nishi Mio (1997, Shokabo Publishing)" ▽ "The Latest Practical Secondary Batteries: How to Select and Use" edited by Japan Battery Co., Ltd. (1999, Nikkan Kogyo Shimbun)" ▽ "The Latest Technology of Secondary Battery Materials" edited by Ogumi Zenpachi (Popular Edition) (1999, CMC) " ▽ "Lithium-Ion Secondary Batteries" edited by Yoshio Masayuki and Ozawa Akiya Materials and Applications (2000, Nikkan Kogyo Shimbun) ▽ Electrochemistry, edited by Ogumi Zenpachi (2000, Ohmsha) ▽ Electrochemical Society, Electrochemistry Handbook (2000, Maruzen) ▽ Battery Handbook Editorial Committee, Battery Handbook (2001, Maruzen) ▽ Secondary Battery Technology for Beginners, edited by Ogumi Zenpachi and Ikeda Hironosuke (2001, Industrial Research Institute) ▽ Materials Chemistry of New Batteries: Quarterly Chemistry Review No. 49 (2001, Academic Society Publication Center) ▽ Kanemura Masashi, Lithium Secondary Battery Technology in the 21st Century (2002, CMC Publishing) [Reference] | | | | | | |©Takashi Aoki Structure of manganese dioxide lithium battery Source: Shogakukan Encyclopedia Nipponica About Encyclopedia Nipponica Information | Legend |
|
負極活物質にリチウムLiを使用する電池の総称で、一次電池と二次電池(蓄電池)がある。また二酸化マンガンリチウム一次電池をさすことがある。リチウムは電気化学的に卑(ひ)な電位をもつ(イオン化傾向の大きな)金属であるだけでなく、金属中でもっとも軽量であることから高い作動電圧をもち、高エネルギー密度の電池を作製することができる。しかしリチウムは水と激しく反応するため電解質には水溶液系を使用することができない。そのため、一次電池ではリチウム電解質塩を有機溶媒に溶解した有機電解液が用いられ、また二次電池では有機電解液のほか、ゲル高分子電解質や固体高分子電解質、ガラス系電解質のような固体電解質、それに溶融塩電解質などが使用されている。 [浅野 満] リチウム一次電池負極活物質にはすべてリチウム金属が使用されるので、正極活物質に使用する材料の名を冠して命名されている。二酸化マンガンリチウム一次電池、フッ化黒鉛リチウム一次電池、塩化チオニルリチウム一次電池、酸化銅リチウム一次電池、二硫化鉄リチウム一次電池、ヨウ素リチウム一次電池などがある。これらは公称電圧が3.0ボルトかそれ以上高いものもあり、マンガン乾電池やアルカリマンガン電池などの一次電池に比べてエネルギー密度が数倍で、貯蔵寿命が長く、長期耐用性があり、低温特性と耐漏液性に優れている。 日本では、1973年(昭和48)松下電器産業(現、パナソニック)により円筒形フッ化黒鉛リチウム一次電池が、そして1975年三洋電機によりコイン形二酸化マンガンリチウム一次電池が世界に先駆けて開発・販売された。これらの一次電池はそれぞれの特性を生かし広い分野で使用されている。2002年における全一次電池に対するリチウム一次電池の生産額比率は33%で、アルカリマンガン電池に次いで多い。リチウム一次電池は負極に化学的に活性なリチウム金属を使用し、また有機電解液などの可燃性材料を使用しているので、従来の1.5ボルトの水溶液系電解液を用いるものに比べて、その取り扱いには十分注意する必要がある。 [浅野 満] 二酸化マンガンリチウム一次電池負極には一般にシート状リチウム金属が使用され、その電極反応は もっとも早く実用化されたコイン形のほか、円筒形、および円筒形を2個パックにしたものがあり、円筒形には誤使用時の内圧上昇に対する安全対策や過電流防止対策などが施されている。高電圧、高エネルギー密度という特徴を生かし、時計、カメラ、電卓、ゲーム機、通信機器、メモリーバックアップ用などの電源に用いられている。電子時計では5~10年間の連続使用が可能になった。 当初はMnO2を正極活物質に用いることは困難とされていたが、400℃前後で熱処理して無水に近いMnO2とすることによりリチウム一次電池に使用することが可能となった。その工学的意義は大きい。安価に製造できるのでリチウム一次電池の主流となっており、生産量の90%以上を占めている。二酸化マンガンリチウム電池、マンガンリチウム電池、あるいは単にリチウム電池と表示されている。 [浅野 満] フッ化黒鉛リチウム一次電池フッ化黒鉛(CF)nが正極活物質に用いられており、その電極反応は一般に [浅野 満] 塩化チオニルリチウム一次電池1970年代初めにアメリカを中心に開発された。正極活物質の塩化チオニルSOCl2は液体であり、電解質塩として用いられる四塩化アルミニウムリチウムLiAlCl4の溶媒も兼ねている。したがって電池中では負極活物質のLiと接触するが、両者の反応によりLi負極面に生成する塩化リチウムLiCl被膜が固体電解質として機能している。正極反応は [浅野 満] 酸化銅リチウム一次電池酸化銅CuO正極の電極反応は [浅野 満] 二硫化鉄リチウム一次電池正極の二硫化鉄FeS2の電極反応は [浅野 満] ヨウ素リチウム一次電池正極活物質のヨウ素I2は高分子のポリ(2‐ビニルピリジン)との電荷移動錯体P2VP・nI2の形で用い、電解質には反応生成物の固体ヨウ化リチウムLiIを利用した3.0ボルトの全固体形で、人工心臓のぺースメーカー用電源として実用化されている。正極反応は [浅野 満] リチウム二次電池一次電池の負極にはリチウム金属が用いられているが、二次電池の負極としては充放電の可逆性に課題が多いため、実用二次電池ではリチウムを吸蔵させた炭素材料やリチウム合金、リチウムと遷移金属との複合酸化物などが用いられ、可逆的に反応が進むようにくふうされている。一方これらの負極と組み合わせる正極にはリチウムを含有する遷移金属酸化物、金属硫化物、導電性高分子、硫黄(いおう)、有機硫黄化合物、リン酸塩などが用いられる。リチウム二次電池は、高放電電圧の高エネルギー密度二次電池として広い分野で使用され、より優れた性能を目ざして新しい電極材料や電解質塩、有機溶媒などの研究開発が活発に行われている。2002年における全蓄電池に対するリチウム二次電池のシェアは48%であり、今後さらに増加するものと思われる。 [浅野 満] リチウムイオン二次電池1991年(平成3)にソニーにより実用化された。それは負極にリチウムを挿入脱離できる黒鉛CyLixを、正極にはコバルト酸リチウムLi1-xCoO2を用い、リチウム電解質塩を溶解した有機電解液を使用するものである。放電反応は 負極材料の炭素には、天然黒鉛のような結晶性の高いものから難黒鉛化性炭素(ハードカーボン)のように結晶性の低いものなど多くの種類が用いられている。正極のLi1-xCoO2はCoが高価なので、資源のより豊富で安価なニッケル酸リチウムLi1-xNiO2もよく研究されているが、2001年現在実用化されているのはLi1-xCoO2とマンガン酸リチウムLixMn2O4である。検討中の正極材料には、リン酸鉄リチウムLiFePO4、置換バナジウム酸リチウムLiMVOx,(M=Cu, Zn, Cd…)、置換ホウ酸リチウムLiMBO3,(M=Mn, Fe, Co…)などがある。有機電解液にはエチレンカーボネート(EC)またはプロピレンカーボネート(PC)とジメチルカーボネート(DMC)、メチルエチルカーボネート(MEC)、あるいはジエチルカーボネート(DEC)との混合溶媒に電解質塩として六フッ化リン酸リチウムLiPF6やビス(トリフルオロメタンスルホニル)イミドリチウムLiN(CF3SO2)2などを溶解したものを使用する。そしてセパレーターにはポリエチレンなどのポリオレフィン系多孔膜が、正極と負極間の隔離と有機電解液の保持を兼ねて用いられている。有機電解液のイオン導電率は、ニッケル水素蓄電池などに使用されるアルカリ水溶液電解液と比べて約102倍低いので、電極板やセパレーターは薄く長くして放電特性の改善が図られている。使用温度範囲はマイナス20~60℃と広く、自己放電率は小さい。 円筒形と角形があり、公称電圧は正極がLi1-xCoO2では3.6ボルト、またLixMn2O4では3.7ボルトと高い。エネルギー密度は130~150Wh/kg、320~390Wh/lで、ニッケルカドミウム蓄電池の約3倍、ニッケル水素蓄電池の約1.5倍である。 日本のメーカーがリチウムイオン二次電池の全世界の需要の大部分をまかなっていて、携帯電話、ノートパソコン、カメラ一体形VTR、ミニディスクプレーヤーなどの移動用電子機器に用いられており、それらの飛躍的発展をもたらした。また2000年(平成12)にはLixMn2O4を正極に用いたリチウムイオン二次電池を搭載したハイブリッド・カー「ティーノ」が日産自動車から限定販売された。 [浅野 満] 金属酸化物負極を用いるリチウムイオン二次電池Li+イオンの挿入脱離を伴う充放電反応に対して結晶構造が安定な遷移金属酸化物負極材料として、アナターゼ形二酸化チタンa-TiO2にLiを挿入させた欠損スピネル構造のチタン酸リチウムLi4/3Ti5/3O4が開発された。マンガン酸リチウムLixMn2O4を正極として、有機電解液を用いるコイン形のリチウムイオン二次電池が1994年から製造販売されている。作動電圧は1.5~1.2ボルトで、エネルギー密度は40Wh/lであり、炭素材料を負極に用いるものより小さいが、電池容量の100%を2000回以上充放電することが可能であり、また過放電に耐え、充電電圧が1.6~2.6ボルトの間で自由に設定できるという特徴がある。そのため高エネルギー密度よりも安全性と信頼性が要求されるソーラー時計、コードレスソーラーディスプレーなどの長期バックアップ電源に用いられている。 そのほか実用化されているものには、単斜晶系の五酸化ニオブNb2O5負極と層状の五酸化バナジウムV2O5正極を用いたコイン形のものが1991年から市販されている。放電電圧は1.8~1.0ボルトでエネルギー密度は47Wh/lであり、充放電サイクル特性がよい。またNb2O5負極とLiCoO2正極を用いるものが知られており、放電電圧は2.8~1.5ボルト、エネルギー密度は107Wh/lと大きい。非晶質系酸化物負極としてスズ複合酸化物SnB0.5P0.5O3がある。1996年には正極としてLiCoO2を組み合わせた円筒形が試作されており、放電電圧は3.5ボルト、エネルギー密度は135Wh/kg、380Wh/lである。また非晶質のリチウムケイ素複合酸化物Li4SiOを負極に用い、正極にLixMn2O4を使用したもの(電池電圧3.0ボルト)と、Li4/3Ti5/3O4を使用したもの(電池電圧1.5ボルト)が1998年に実用化されている。さらに窒化物系のLi3-xMxN(M=Co, Ni, Cu)負極が研究されている。 [浅野 満] 置換マンガン酸リチウム正極を用いるリチウムイオン二次電池正極材料に用いられるLiMn2O4のMnの一部をほかの遷移金属で置換して置換スピネル形マンガン酸リチウムLiMn2-xMxO4(M=Ti, Cr, Fe, Co, Ni, Cu, Zn)とすると、スピネル構造が安定化し、サイクル特性や保存特性を改善することができる。また、これらの置換形のうちCoで置換したLiCoMnO4は、Li負極に対して4ボルト付近だけでなく5ボルト付近でも平坦な放電電圧を示し、LiNi0.5Mn1.5O4も4.7ボルトを示すことがわかり、大きな関心がもたれている。LiCoO2正極に比べ容量と充放電サイクル特性に劣るが、高電圧に耐える有機電解液が開発できれば、リチウムイオン二次電池の高電圧化による高エネルギー密度化を図ることができるため、いっそうの研究開発が期待されている。 [浅野 満] ゲル高分子電解質を用いるリチウムイオン二次電池携帯電子機器の小形化に伴い、リチウムイオン二次電池をさらに小形、軽量、薄形化するため、ゲル状の高分子電解質を用いたものが1999年に実用化された。通常のリチウムイオン二次電池では有機電解液が使用されており液漏れの危険がある。そこで密封化するために液体電解質にかえてゲル高分子電解質を用い、また容器にも鉄缶やアルミニウム缶のかわりにアルミラミネートフィルムを使用して軽量化が図られた。このゲル高分子電解質はゲル高分子とリチウム電解質塩に可塑剤として有機溶媒を添加して作製したもので、室温におけるLi+イオン導電率は約10-3S/cmと有機電解液の5×10-3S/cmに近い。正負両極の活物質には通常のリチウムイオン二次電池に用いられている材料と同じものを使用することが多い。 ゲル高分子電解質用の高分子には一次元直鎖高分子のポリエチレンオキシド(PEO)やポリフッ化ビニリデン(PVdF)、ポリアクリロニトリル(PAN)、PVdF‐ポリヘキサフルオロプロピレン(PHFP)共重合体などが用いられ、リチウム電解質塩にはLiPF6やLiN(CF4SO2)2、トリフルオロメタンスルホン酸リチウムLiCF3SO3が、そして有機溶媒にはECとDMCまたはEMCとの混合溶媒が主として使用されている。また一次元直鎖高分子の耐熱性や機械的強度などを向上させるために、アクリル系モノマーをリチウム塩と有機溶媒に混合したのち重合させた三次元化学架橋ゲル高分子電解質が研究されている。 正負両極内におけるLi+イオンの移動と伝導性をよくするために、あらかじめ両極活物質のそれぞれをゲル高分子電解質と混練して作製した電極が用いられる。また正負電極とゲル高分子電解質薄膜との密着性をよくするため、さまざまなくふうがされている。 ゲル高分子電解質を用いたリチウムイオン二次電池は通常の有機電解液を使用したものと同等の電池特性を有し、たとえば黒鉛|ゲル高分子電解質|LiCoO2構成のものでは放電電圧として3.6~3.7ボルトが得られる。薄形で柔軟性のあるタイプを作製できるので、ノートパソコンや携帯電話などの軽量、小形化に寄与している。 [浅野 満] 固体高分子電解質を用いるリチウム二次電池高分子電解質には、有機溶媒を使用せず、ポリエチレンオキシド系共重合体に電解質塩としてLiN(CF3SO2)2を添加して作成した真性の固体高分子電解質がある。室温におけるLi+イオン導電率はゲル高分子電解質に比べて2桁(けた)以上低くなるが、60℃以上で十分な導電率が得られるため高温形リチウム二次電池といわれる。負極にリチウム金属を用いることが可能で、正極に酸化バナジウムVOxを用い、Li|固体高分子電解質|VOxの3層を一体化し、外装にラミネートフィルムを用いた全固体形リチウム二次電池では、60℃で放電電圧2.5~2.3ボルトが得られ、出力密度は400Wh/kg以上、エネルギー密度は300Wh/kgを超える。可塑剤として有機溶媒を使用していないので、貯蔵性、安全性、信頼性が高く、室温作動させる必要のない分野で実用化されよう。 この二次電池は固体高分子電解質の開発が鍵(かぎ)を握っており、室温作動の高イオン導電性高分子電解質が開発されれば、全固体形リチウム二次電池の実現へ一歩近づくことができる。 [浅野 満] 高分子正極を用いるリチウム二次電池2000年現在、実用化されているリチウム二次電池の電極活物質には炭素や合金、金属酸化物などの無機物質が用いられているが、共役二重結合をもった導電性高分子を用いることができる。たとえば、電解質塩にLiClO4を用いた場合、充電時にはClO4-アニオンが高分子正極にドープ(添加)され、同時にLi+カチオンが負極にドープされる。ここで高分子正極活物質を(P)nで表すと正極の充電反応式は以下のようになる。 (P)n+nxClO4- 正極用導電性高分子には当初ポリアセチレンが研究されたが、劣化しやすいので、その後ポリピロール、ポリチオフェン、ポリアセンなどが検討された。そして1991年にはポリアセン系有機半導体(PAS)を使用したLiPAS負極|LiPAS正極構成のものがカネボウとセイコーインスツルメンツより市販された。ポリアセンはフェノール樹脂などを700℃以下の低温で焼成した炭化過程の炭素材料である。公称電圧は2.5ボルトであるが、放電に伴う電圧変化が比較的大きい。コイン形がメモリーバックアップ用に用いられている。高分子であるため薄形化が可能であり、電力をあまり必要としない分野での利用に有効である。なお、1987年(昭和62)にはリチウムアルミニウム合金|ポリアニリン系のコイン形がブリヂストンとセイコーインスツルメンツにより実用化されたが、現在は生産されていない。 [浅野 満] 有機硫黄化合物正極を用いるリチウム二次電池有機ジスルフィド化合物(SRS)は分子内にチオレート基(‐SM、M=H, Liなど)を二つ以上もっており、充電(酸化)すると高分子化して‐(SRS)n‐となり、放電(還元)によりSRSモノマーに戻る。したがって、この性質を利用して正極とし、Li負極と組み合わせてリチウム二次電池とすると、95℃で3.0~2.5ボルトの放電電圧が得られる。またSRS正極の酸化還元反応速度を速めて室温で使用可能とするためポリアニリンと複合化すると、3.4~3.2ボルトに作動電圧を高めることができる。さらに‐(SRS)n‐のRを炭素原子としたポリカーボンジスルフィド化合物(CSx)n(x=1.2~2.3)を導電性高分子と複合化して正極とすると2.4~1.7ボルトの放電電圧が得られ、硫黄単体/導電剤複合系を正極に用いても2.0ボルトの放電電圧が得られるので、これらの構成によりリチウム二次電池を作製できる。 [浅野 満] リチウムアルミニウム合金負極を用いるリチウム二次電池リチウム二次電池として最初に実用化されたものは、負極にリチウムアルミニウムLiAl合金を用いたコイン形で、リチウムイオン二次電池よりも早い1988年のことである。代表的なものとして負極にLiAl合金、正極に三洋電機で開発された改質二酸化マンガン(CDMO)を用いたリチウム二次電池がある。 MnO2には種々の結晶構造のものがあるが、γ‐MnO2がリチウム一次電池の正極に用いられている。しかし二次電池の正極として充放電を繰り返すと劣化してしまうので、γ‐MnO2とLi2MnO3を複合化させたCDMOが用いられている。また負極のLiAl合金のLi原子比は約50%で、第3成分としてMnなどを加えて充放電による微粉化を抑制してサイクル特性の改善が図られている。 CDMOを便宜上Mn(Ⅳ)O2で表すと、放電反応は 一方、LiAl合金負極を用いる高温形リチウム二次電池がアメリカのアルゴンヌ国立研究所で1970年代から研究され始めた。当初はLi金属が用いられたこともあったが、融点が低いためにLiAl合金とし、正極には二硫化鉄FeS2、電解質に塩化リチウムLiCl‐臭化リチウムLiBr‐臭化カリウムKBr系溶融塩(共融温度320℃)を用いるもので、作動温度は400~450℃である。放電反応は 負極に用いることのできるリチウム合金にはLiAl合金以外にマグネシウム、銀、鉛、ビスマス、カドミウム、ゲルマニウムとリチウムとの合金やリチウムウッド合金などが知られている。またMg2SnやSn-Ca系などを負極に用いることが検討されている。 [浅野 満] 薄膜形固体リチウム二次電池正リン酸リチウム(Li3PO4)を窒素ガス中でスパッタリング(イオンを照射して発散した物質を付着させること)して作製したリチウムリンオキシ窒化物(LixPO4-yNy)薄膜を固体電解質に用いる数マイクロメートル厚さの薄膜形固体リチウム二次電池が1993年にアメリカのオークリッジ国立研究所とケンタッキー大学との共同で開発された。これはLi負極、LixPO4-yNy電解質、V2O5正極の各薄膜を順次析出させて作製するもので、3.7~1.5ボルトレンジで100μA/cm2の放電電流密度が得られている。このほか、ヨウ化リチウム‐五酸化リン‐五硫化リン系ガラス状固体電解質と、二硫化チタンTiS2正極およびLi負極を組み合わせた薄膜固体リチウム二次電池などが研究されている。 [浅野 満] 『高村勉・佐藤祐一著『ユーザーのための電池読本』(1988・コロナ社)』▽『池田宏之助著『電池の進化とエレクトロニクス――薄く・小さく・高性能』(1992・工業調査会)』▽『池田宏之助編著、武島源二・梅尾良之著『「図解」電池のはなし』(1996・日本実業出版社)』▽『小久見善八監修『新規二次電池材料の最新技術』(1997・シーエムシー)』▽『西美緒著『リチウムイオン二次電池の話――ポピュラー・サイエンス』(1997・裳華房)』▽『日本電池株式会社編『最新実用二次電池 その選び方と使い方』(1999・日刊工業新聞社)』▽『小久見善八監修『最新二次電池材料の技術』普及版(1999・シーエムシー)』▽『芳尾真幸・小沢昭弥編『リチウムイオン二次電池 材料と応用』(2000・日刊工業新聞社)』▽『小久見善八編著『電気化学』(2000・オーム社)』▽『電気化学会編『電気化学便覧』(2000・丸善)』▽『電池便覧編集委員会編『電池便覧』(2001・丸善)』▽『小久見善八・池田宏之助編著『はじめての二次電池技術』(2001・工業調査会)』▽『『新型電池の材料化学 季刊化学総説No.49』(2001・学会出版センター)』▽『金村聖志編『21世紀のリチウム二次電池技術』(2002・シーエムシー出版)』 [参照項目] | | | | | | |©青木 隆"> 二酸化マンガンリチウム電池の構造 出典 小学館 日本大百科全書(ニッポニカ)日本大百科全書(ニッポニカ)について 情報 | 凡例 |
<<: ricercare - ricercare (Italian)
>>: Lithium - Lithium (English spelling)
Recommend
Ventilation (Medicine) - Ventilation
…In contrast, the lungs of land animals are organ...
After the blaze - Arabiake
...The first Buddhist ceremony was held at Asukad...
Corallus caninus (English spelling)
...Indian pythons and other species are captured ...
Sea stone - Kaijōkoku
…A type of miscellaneous tax in early modern Japa...
Śabarasvāmin (English spelling)
An Indian philosopher who lived around 550, and a ...
catholic
...A world view or system of thought based on Cat...
Celtic art
Celtic art from the 6th century BC to the 3rd cent...
Cancellation deposit - Kaiyakutte Tsuke (English) deposit
A deposit that has the effect of restricting the ...
Karoku (English spelling) Formosan deer
Also known as the Formosan Sika Deer or Nosed Sika...
Yellow-spotted wasp - Yellow-spotted wasp
...They hunt moth larvae and store them in their ...
Duquesnoy, François
Born: 1594/1597 Brussels [Died] July 12, 1643. Liv...
Banken (English spelling) coucal
A general term for birds of the Centropus genus in...
cetiya
…In ancient India, the Sanskrit word for an objec...
Boxwood - Boxwood
An evergreen small tree of the Buxaceae family (A...
Herbal medicine - shoyaku
Natural substances that occur in nature and that ...